Недостатки воды, как теплоносителя
Во всех инструкциях по эксплуатации, рекомендациях производителей и справочниках для монтажников систем отопления единогласно утверждается: стандартный теплоноситель для использования в отопительных системах — это дистиллированная очищенная вода.
Последнее не актуально, если дом с водяной системой отопления является постоянным местом проживания. Но что делать, если это система отопления дачи, гаража, домика для гостей… риск замерзания воды в таких системах отопления значителен. В таком случае выход один: использовать антифриз для котлов отопления… но это совсем другая история.
Как разбавлять концентрат антифриза
Для получения правильного раствора, необходимо сначала понять, в каком температурном диапазоне антифриз будет работать. Как правило, температура замерзания антифриза равняется шестидесяти пяти градусам ниже нуля. По причине того, что такие температуры в умеренной широте практически не встречаются, в данный раствор можно добавить воды, так как это сделает температуру замерзания гораздо выше. Итак, как разбавлять концентрат антифриза:
- Пропорция один к одному характеризуется температурой замерзания – тридцать пять – сорок градусов ниже нуля Пропорция 2/3 (то есть, два литра концентрата и три литра воды) характеризуется температурой замерзания – тридцать градусов ниже нуля Пропорция один к двум характеризуется температурой замерзания в двадцать градусов ниже нуля
Антифриз нужно разбавлять только дистиллированной водой, которая предназначается специально для этого. Не рекомендуется смешивать концентрат с дистиллированной водой из аптеки, с водопроводной водой, с морской водой и так далее. По причине содержания большого количества солевых соединений, такая жидкость будет оставлять осадок в системе охлаждения автомобиля.
Ряд производителей антифризов в своих инструкциях не настаивают на использовании только дистиллированной воды, а допускают использование любой. Рекомендуется в таком случае, произвести проверку: в подготовленную тару залейте концентрат и воду и оставьте на двое суток. При появлении осадка, можно будет сделать вывод, что лучше приобрести специальную дистиллированную воду.
«>
Что такое этиленгликоль
Этиленгликоль — это представитель спиртов с двумя метильными группами в своём составе. Но в отличие от других он имеет немного маслянистую консистенцию.
Несмотря на то что этиленгликоль был получен ещё в 1859 году, он не сразу занял свою нишу в химии и промышленности. Изначально он использовался во времена Первой мировой войны, как замена глицерина, который широко применялся при производстве взрывчатых веществ.
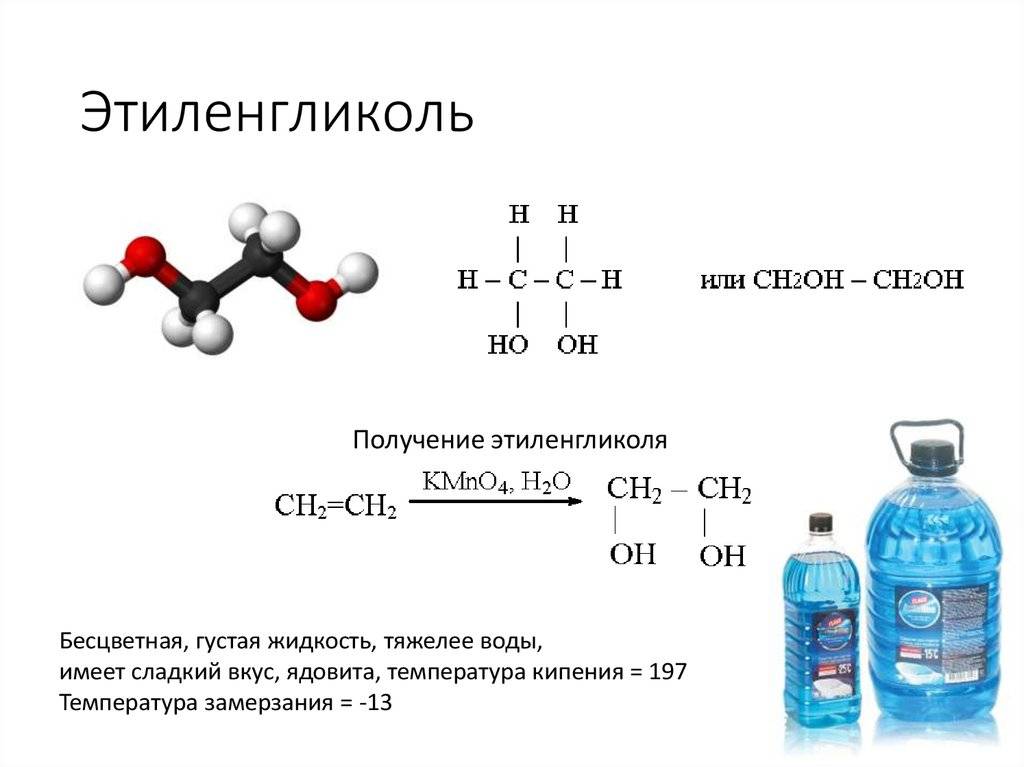
Химическая формула этиленгликоля — C2H6O2, рациональная — С2Н4(ОН)2. По своим физическим свойствам — это жидкость без запаха, но со сладким вкусом. Он легко соединяется с водой в любой консистенции, что успешно применяется в промышленности, ведь температура замерзания таких жидкостей очень низкая — это улучшает свойства «незамерзаек».
 У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Чаще других употребляется основное название.
К какому классу опасности относится этиленгликоль? — к умеренно токсичное легковоспламеняющееся вещество.
Способы получения
Производством этиленгликоля в промышленных масштабах занялись ещё в тридцатые годы прошлого века. Одним из способов его получения тогда было окисление этилена до его оксида. Около 20 лет такой метод оставался единственным.
Немного позже этиленгликоль стали получать с помощью насыщения оксида этилена водой, в присутствии серной и ортофосфорной кислот. Этот способ оказался выгодней предыдущего, так как на выходе производили более 90% этиленгликоля с минимальным количеством примесей.
Где применяется
В основном этиленгликоль используют в промышленности для обработки техники, что обусловлено его стоимостью — это недорогой и всем доступный продукт.
 Он выпускается в химической промышленности для ухода за автомобилями:
Он выпускается в химической промышленности для ухода за автомобилями:
- более 50% вещества идёт на создание тормозных жидкостей и антифризов, так как смесь гликоля и воды способна сохранять жидкую консистенцию даже при 40º C ниже нуля;
- этиленгликоль входит в состав охлаждающей жидкости — тосола;
- он может устранять коррозию, поэтому гликоль добавляют в антикоррозийные химические соединения.
Где ещё используется этиленгликоль?
- Его можно обнаружить в составе антистатиков.
- Используют для производства средств защиты против обледенения.
- Служит смазкой в холодильных установках.
- Находит применение этиленгликоль как наполнитель в гидравлических системах.
- Гликоль нередко используют для дезинфекции больших помещений.
- Одно из ключевых применений вещества — это производство бытовых химических продуктов, к числу которых относится целлофан, полиуретан.
- Он используется не только при охлаждении автомобилей, но и компьютеров.
- Этиленгликоль или химические соединения в составе с ним применяется, как средство для чистки автомобильных стёкол и зеркал.
- В небольшом количестве присутствует в креме для обработки обуви.
- Применяется этиленгликоль и в медицине, как составная часть криопротекторов для тканей и органов. То есть веществ, которые используют для заморозки.
- Это один из компонентов конденсаторов.
- Ключевым свойством этиленгликоля является поглощение воды, что успешно используется, чтобы предотвратить обледенение топлива в авиации и синтеза гидрата метана в трубопроводах, которые проходят в море.
- В органической химии его применяют как высокотемпературный растворитель.
- Без него не проходит синтез химических соединений.
- Где ещё используется этиленгликоль? — даже в наше время с его участием создают взрывчатые вещества.
За прошедшие десятилетия для этого двухатомного спирта нашлось множество применений, что, конечно же, обусловлено его свойствами. Но в медицине он известен не только как полезный и нужный продукт в быту, но и как средство, после контакта с которым человек может умереть.
Так что это такое этиленгликоль? — полезное химическое вещество, без которого не обходится производство большинства органических соединений или сильнодействующий яд с мощным отравляющим эффектом? Давайте узнаем, как может повлиять этиленгликоль на человека.
Клиническая картина острой интоксикации
Характерная черта этого расстройства — появляется оно сразу, незамедлительно
В этом случае важно оказать помощь на ранней стадии
Возникновение острой интоксикации связано с проникновением в организм большого количества веществ, обладающих токсическим действием, употреблением пищи или воды ненадлежащего качества или выраженной передозировкой лекарственных препаратов. Характер течения и степень тяжести интоксикации определяется разновидностью токсического вещества, попавшего в организм.
Проявления острой интоксикации
Наиболее характерные проявления острой интоксикации:
- выраженная резкая боль в области желудка;
- неудержимая рвота;
- остро появившийся жидкий стул.
Рвота и понос в этой ситуации — реакция организма на отравление, с помощью которой он старается очиститься от токсического вещества. Поэтому первое время после появления такой симптоматики нет смысла стараться ее заблокировать.
Экзогенная интоксикация
Токсические вещества, вызывающие расстройства, могут проникать в организм различными способами: через пищеварительный тракт, слизистые оболочки, кожный покров, через дыхательные пути.
Заподозрить экзогенную интоксикацию помогут следующие симптомы:
- Выраженная гипертермия.
- Лихорадочное состояние.
- Острая реакция со стороны пищеварительного тракта: рвота, диарея, выраженная изжога. При отравлении растворами, имеющими щелочную или кислую реакцию, в рвоте могут присутствовать сгустки крови.
- Судорожные сокращения мышц конечностей.
- Ухудшение картины рефлексов.
В случае трансдермального проникновения яда в организм или попадания его через слизистую оболочку, в большинстве случаев наблюдается местная реакция в виде выраженных аллергических проявлений: покраснений, очагов высыпаний, напоминающих ожоги.
Важным признаком экзогенной интоксикации синдрома является острое кислородное голодание всех тканей организма. Оно обусловлено способностью токсинов блокировать возможность эритроцитов переносить кислород. Гипоксия приводит к расстройству всех систем жизнеобеспечения организма человека:
- снижается частота пульса;
- развивается распространённый отёчный синдром, наиболее опасны отёк лёгких и головного мозга.
Эндогенная интоксикация
Интоксикационный синдром эндогенного происхождения — не самостоятельное заболевание. Он сопровождает многие заболевания и является частью их патогенеза.
Эндотоксинами или аутоядами называются вещества, которые вырабатываются внутри организма в результате распада молекул или клеточных структур. Обладая токсическими свойствами, эти вещества вызывают развитие недостаточности работы жизненно важных органов: почек, печени, сердца.
Проявления эндогенной интоксикации:
- головная боль;
- нарушение сна;
- исчезновение аппетита.
Такой симптомокомплекс часто наблюдается при интоксикационном синдроме, сопровождающем инфекционно-воспалительные заболевания.
В случае более выраженной степени интоксикации добавляются следующие симптомы:
- снижение суточного объёма мочи;
- головокружение;
- ощущение прогрессирующей накопившейся хронической усталости;
- нарушение ритма работы сердца;
- галлюцинации — признак тяжёлого интоксикационного синдрома, который сопровождается лихорадкой, в частности, этот симптом характерен для ожоговых травм при поражении большой площади тела с глубиной ожогов 3–4 степени.
В некоторых случаях к указанной симптоматике общего характера добавляются специфические признаки, которые могут помочь при диагностике. Например, желтушное окрашивание склер и кожных покровов при поражении печени билирубином.
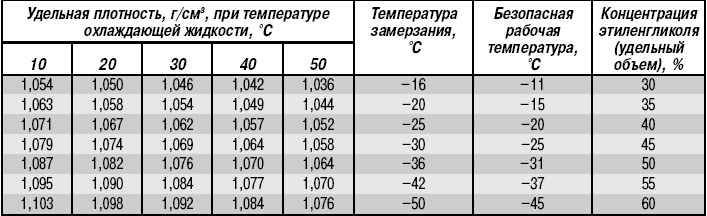
Важнейшие требования ГОСТ 19710 к готовому гликолю
С 1984 года действует ГОСТ 19710, который устанавливает требования к тому, какие свойства (температура замерзания, плотность и так далее) должен иметь этиленгликоль, используемый на предприятиях автомобилестроения и в других отраслях народного хозяйства, где на его основе выпускают разнообразные составы.
По ГОСТ 19710 гликоль (как жидкость) может быть двух типов: первого сорта и высшего сорта. Доля (массовая) воды в гликоле первого сорта должна быть до 0,5 %, высшего – до 0,1 %, железа – до 0,00005 и 0,00001 %, кислот (в пересчете на уксусную кислоту) – до 0,005 и 0,0006 %. Остаток после прокаливания готового продукта не может быть более 0,002 и 0,001 %.

Цвет 1,2-диоксиэтана по ГОСТ 19710 (по шкале Хазена):
- после кипячения в растворе кислоты (соляной) – 20 единиц для продукции высшего сорта (первый сорт не нормируется по цвету);
- в стандартном состоянии – 5 (высший сорт) и 20 единиц (первый сорт).
В Государственном стандарте 19710 выдвигаются специальные требования к процессу производства описываемого простейшего спирта:
- используется исключительно герметичная аппаратура и оборудование;
- производственное помещение обязательно оснащается вентиляцией, рекомендованной для работы с соединениями, которым присвоен третий класс опасности;
- при попадании гликоля на оборудование или землю его следует сразу же обильно смывать водной струей;
- персонал, работающий в цеху по производству 1,2-этандиола, обеспечивается противогазом модели «БКФ» либо иным приспособлением для защиты органов дыхания, соответствующим ГОСТ 12.4.034;
- возгорания гликоля тушат при помощи инертных газов, специальных пенных составов, а также тонкораспыленной воды.

Готовая продукция по ГОСТ 19710 проверяется различными методами. Например, массовая часть двухатомного спирта и диэтиленгликоля устанавливается способом изотермической газовой хроматографии по технологии так называемого «внутреннего эталона». При этом используются весы для лабораторных исследований (ГОСТ 24104), стеклянная или стальная газохроматографическая колонка и хроматограф с детектором ионизационного типа, измерительная линейка, микрошприц, лупа оптическая (ГОСТ 25706), выпарительная чашка и другой инструмент.
Цвет гликоля устанавливают по стандарту 29131 при помощи секундомера, специального цилиндра, конической колбы, соляной кислоты, холодильного агрегата. Массовая часть железа устанавливается по Госстандарту 10555 по методике сульфациловой фотометрии, остатка после прокаливания – по Госстандарту 27184 (посредством выпаривания полученного соединения в платиновой либо кварцевой емкости). А вот массовая часть воды определяется электрометрическим или визуальным титрованием с использованием реактива Фишера в бюретках емкостью 10 либо 3 кубических сантиметра.
Многопрофильное вещество
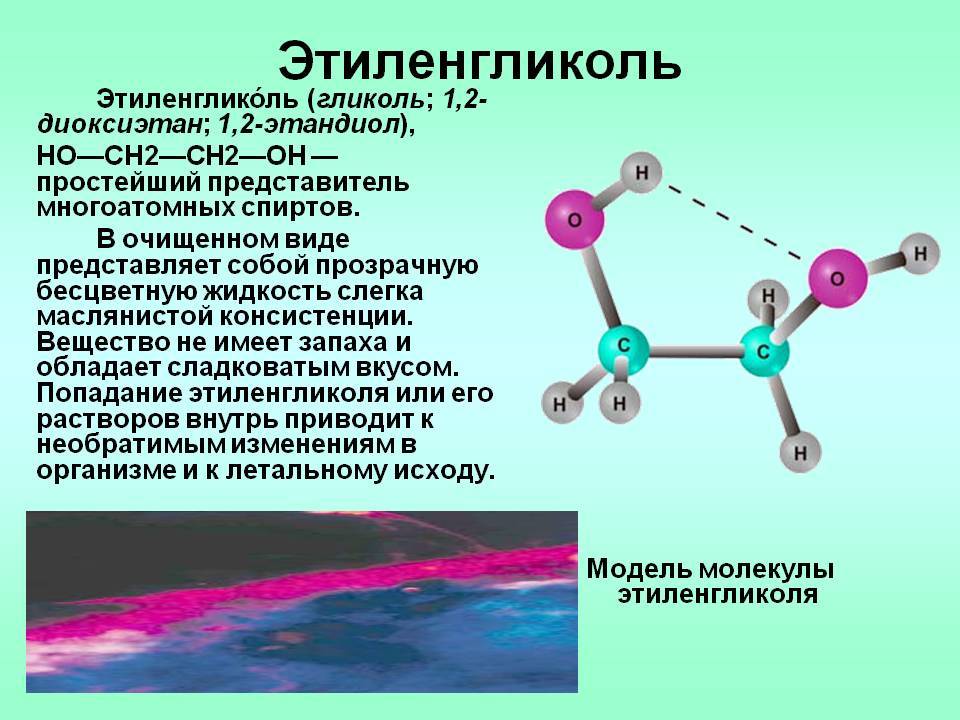
Этиленгликоль – один из наиболее популярных видов нефтехимического сырья и компонент для многих промышленных продуктов. Это двухатомный спирт, который в очищенном виде выглядит, как бесцветная жидкость без запаха. Вещество достаточно токсично и отнесено к третьему классу опасности по международной классификации.
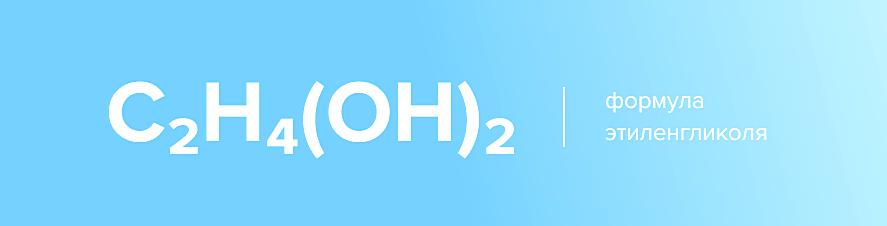 Формула этиленгликоля
Формула этиленгликоля
- в высокой концентрации он переносит нагрев почти до 200 градусов, что позволяет использовать их в теплоносителях;
- температура их кристаллизации в смеси с водой может опускаться вплоть до 75 градусов ниже нуля. Это делает МЭГ наиболее популярным компонентом антифризов автомобильных систем охлаждения. Максимальной морозоустойчивости МЭГ достигает в пропорции с водой в 25/75%.
 Основные характеристики этиленгликоля
Основные характеристики этиленгликоля
Но полвека с момента его открытия этиленгликоль фактически «пролежал на полке».
Презентация на тему: ” Этиленгликоль Выполнила: Лыткина А.Д. Этиленгликоль Этиленглико́ль гликоль двухатомный спирт, простейший представитель многоатомных спиртов. В очищенном.” — Транскрипт:
1
Этиленгликоль Выполнила: Лыткина А.Д

2
Этиленгликоль Этиленглико́ль гликоль двухатомный спирт, простейший представитель многоатомных спиртов. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу

3
Этиленгликоль Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем в 1860-м. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ.

4
Этиленгликоль В промышленности этиленгликоль получают путём гидратации оксида этилена при °С или при °С в присутствии серной или ортофосфорной кислоты. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимер гомологов этиленгликоля.

5
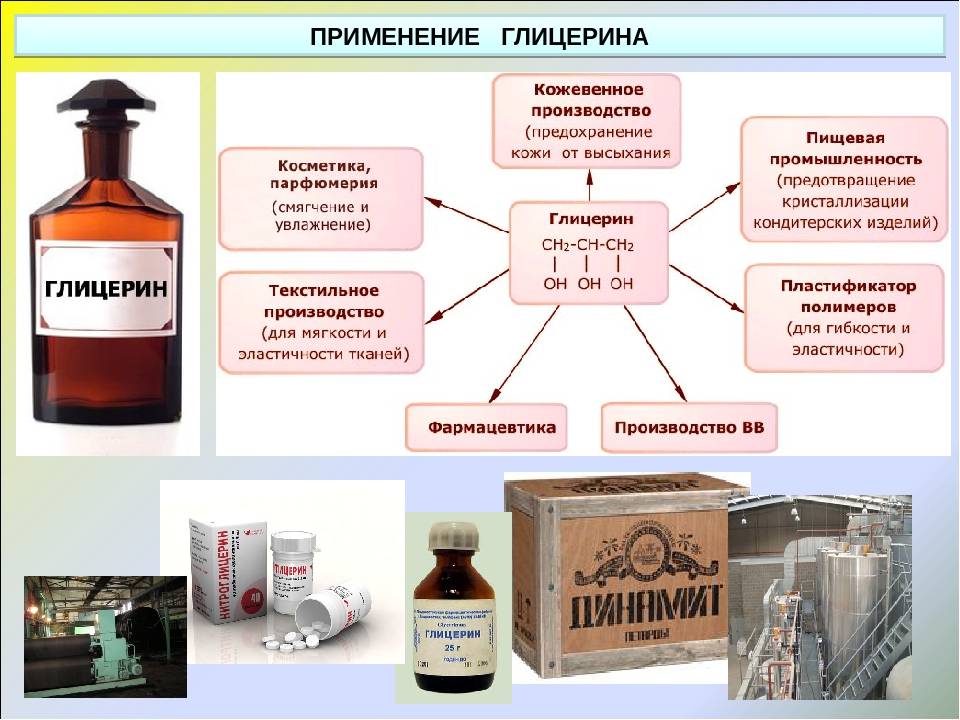
Применение Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике. Как компонент автомобильных антифризов и тормозных жидкостей В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров; В производстве целлофана; Как растворитель красящих веществ; В органическом синтезе В качестве высокотемпературного растворителя.

6
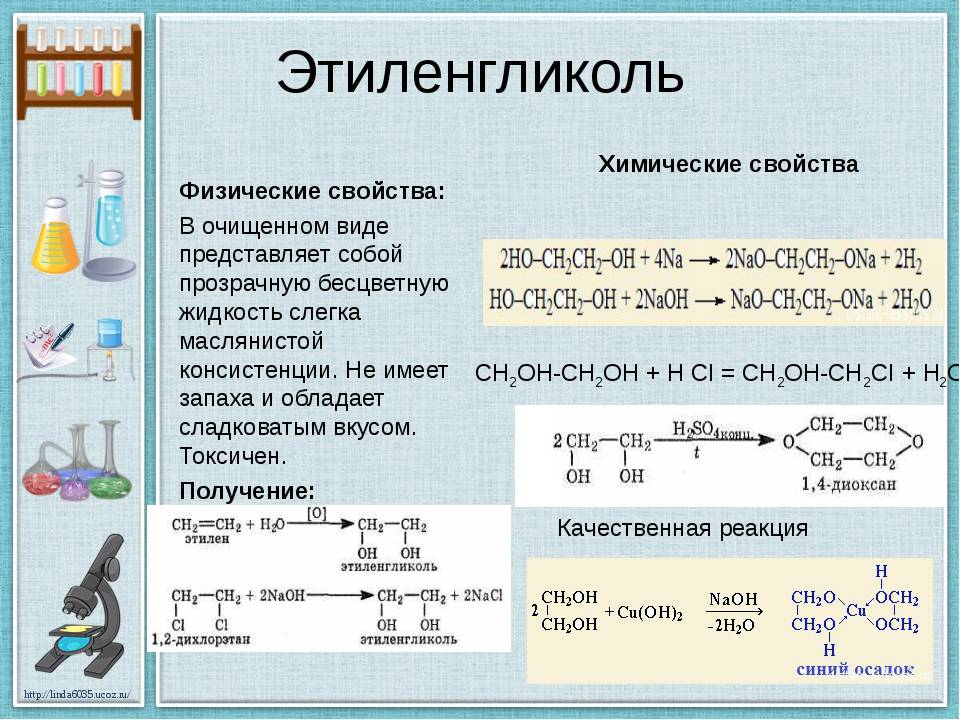
Этиленгликоль горючее вещество. Температура вспышки паров 120 °C.. Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности. Летальная доза при однократном пероральном употреблении составляет мл этиленгликоля.Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол. В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой.

Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии этиленгликоля с галогеноводородами группы ОН замещаются на галоген и образуются дигалогеналкан.
| Например, этиленгликоль реагирует с бромоводородом. |
CH2(OH)-CH2OH + 2HBr → CH2Br-CH2Br + 2H2O
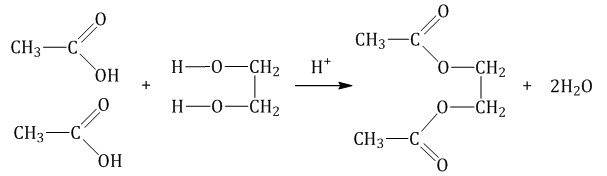
2.2. Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием эфира: |
2.4. Взаимодействие с кислотами-гидроксидами
Этиленгликоль взаимодействует и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этиленгликоля с азотной кислотой образуется нитроэтиленгликоль: |
Номенклатура спиртов
По систематической номенклатуре ИЮПАК (IUPAC)
Спиртам дают название по названию углеводорода с добавлением суффикса -ол и цифры, которая показывает положение гидроксильной группы. Для того, чтобы правильно определить, с каким по счету атомом углерода соединена гидроксильная группа, необходимо учитывать следующие правила:
Выбрать самую длинную углеводородную цепь, в состав которой входит гидроксильная группа. Таким образом устанавливают число атомов углерода и соответственно формируют название.
Нумерацию длинной цепи осуществляют с того края, к которому ближе расположена гидроксильная группа.
Местоположение гидроксогруппы в названии определяют написанием цифры после суффикса -ол.
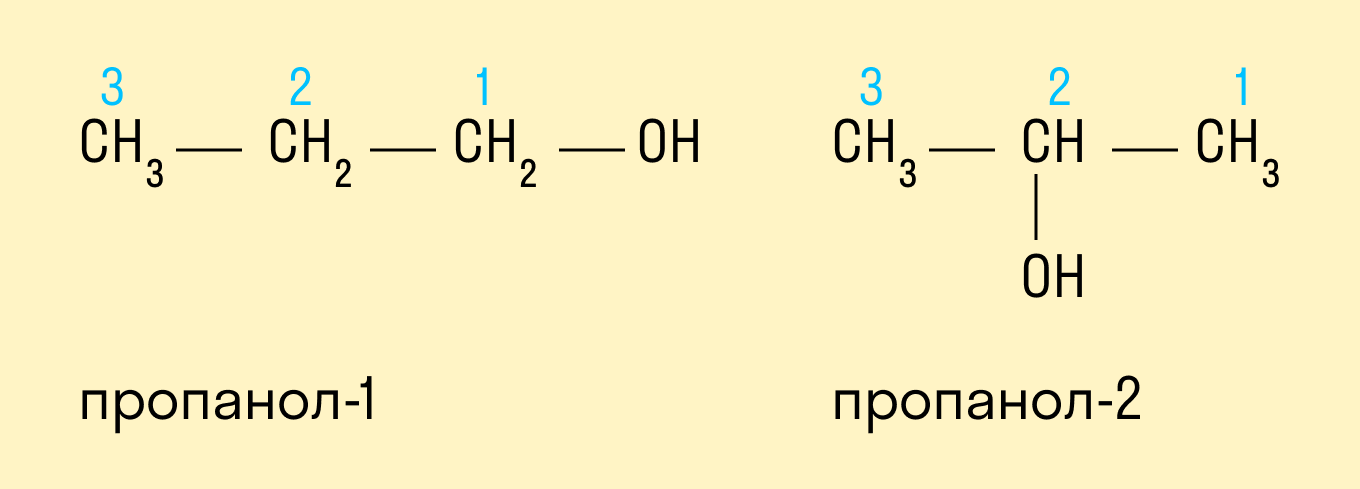
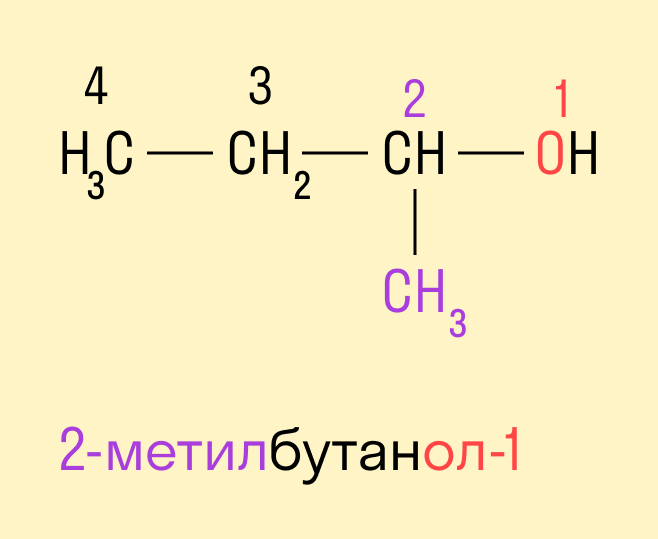
Если в составе спирта присутствуют другие функциональные группы, то нумерация углеродного скелета начинается с того края, где расположена старшая функциональная группа. В таком случае перед названием указывают цифрой, от какого атома углерода идет ответвление.
Радикально-функциональная номенклатура
По такому способу название спирта формируется от названия радикала с добавлением слова «спирт». Например:
СH3—OH — метанол или метиловый спирт;
C2H5OH — этанол или этиловый спирт;
CH3—CH2—CH2—СН2—OH — бутанол или бутиловый спирт.
Чем опасна
Курение – опасность. Угроза здоровья населения. Курильщики подтверждают нежелание отказаться от соблазна покурить после сытного обеда, на автобусной остановке, в процессе ожидания, или просто от безделья.
Технологии и инновации дали продвижению разработки и внедрение электронок в мировой сигаретный бизнес. Ядовитые вещества в курительном элементе, основательно исчезли.
Нельзя считать сигаретные альтернативы плодотворно влияющими. Десятиминутное использование курительного приспособления производит заметное нарушение в дыхательных путях человека.
Процесс плохо сказывается на здоровье. Происходит сопротивление дыхательных путей, и это увеличивает риск появления и развития астмы.
Процесс амбулаторного лечения может эффективно сказаться на выздоровлении больного, но болезнь может непредсказуемо прогрессировать. Электронки вредны. В составе жидкости отсутствуют смолы, угарный газ, химические вещества, тар, мышьяк, бензоперин, толуол, акролеин, никель, кадмий, формальдегид и другие вещества.
Многообещающая динамика
Объемы производства этиленгликоля, которые уже сейчас в мире приближаются к 30 млн. тонн, постоянно увеличиваются.
По прогнозам экспертов, как минимум до 2025 года динамика роста спроса на МЭГ составит 5-6% в год. Россия пока не занимает существенной доли в мировом производстве. В 2021 году внутренние производители (СИБУР, Казаньоргсинтез и Нижнекамскнефтехим) выпустили менее 400 тыс. тонн этиленгликолей, что связано с низкими темпами увеличения спроса внутри страны и высокой конкуренцией на экспорте.
Благодаря возможности разностороннего применения, этиленгликоль стал незаменимым компонентом для многих промышленных отраслей. При этом экономическая эффективность его применения и перспективы дальнейшего развития в качестве экологичного сырья гарантируют МЭГ стабильный спрос еще долгие годы.
Закипел антифриз долью такой же
Если у вас «убежал» антифриз — у вас две возможные проблемы:
- проблемы в системе охлаждения, как правило, с радиатором
- проблемы с охлаждающей жидкостью
Второе — наиболее частая ситуация. И в 90% случаев это происходит с «метанольными» смесями — подделками под антифриз, где дорогой этиленгликоль заменяют на дешевую смесь глицерина и метанола. Последний закипает уже при температуре 85⁰С в системе.
Поэтому, если вы закипели — дайте системе остыть и долейте воды (лучше — дистиллированной). Разбавленная водой метанольная смесь хуже автомобилю уже не сделает. Однако как можно скорее запишитесь в автосервис и замените жидкость на соответствующую вашему автомобилю.
Пропиленгликоль и его свойства. Статьи компании «ТОВ «МIКС»»
Пропиленгликоль (монопропиленгликоль -1,2-пропандиол, 1,2-дигидроксипропан) – органическое соединение, двухатомный спирт алифатического ряда, химическая формула СН3СН(ОН)СН2ОН. Название образуется от углеводородного радикала – пропилена и слова гликоль, означающего двухатомный спирт. Характеристики пропиленгликоля: плотность — 1,0363 г/см³, температура кипения 189°С, температура воспламенения — 111°С
Пропиленгликоль – вязкая жидкость без цвета и запаха, сладковатая на вкус, с хорошими гигроскопическими свойствами (легко впитывает воду), хороший растворитель для гидрофильных (хорошо растворимых в воде веществ – это соли, сахара, аминокислоты) и гидрофобных (в воде практически не растворимые — это жиры), поэтому широко используется для получения растворов химических веществ, не растворимые друг в друге.

ПРИМЕНЕНИЕ ПРОПИЛЕНГЛИКОЛЯ
Пропиленгликоль не токсичен, не вызывает отравление при попадании внутрь организма, не опасен даже при длительном вдыхании, взрыво-, пожаро- и экологически безопасен. Пропиленгликоль нашел широкое применение во многих странах мира в пищевой и фармацевтической отраслях промышленности в качестве пищевой добавки Е1520.
Пропиленгликоль высокой чистоты используется для придания продуктам питания желаемых свойств, например определенного цвета (красители), длительности хранения (консерванты), аромата (ароматизаторы), а также для получения нужного качества, консистенции и вкуса пищевых продуктов, а также в качестве растворителя для экстракции многих природных ароматизирующих веществ, а также используется в качестве носителя, смягчителя и увлажнителя во многих видах косметической продукции для смягчения и увлажнения кожи: при приготовлении шампуней, эмульсий, лосьонов, эликсиров, паст, кремов, помад и других препаратов.

Пропиленгликоль широко применяется для получения экологически чистых, взрыво- и пожаробезопасных водных растворов — теплоносителей (антифризов, хладагентов, незамерзающих жидкостей) для систем отопления и кондиционирования жилых помещений, производственных помещений для пищевой, фармацевтической, косметической промышленности, а также для использования в системах промышленного кондиционирования при производстве и хранении пищевых продуктов. В зависимости от климатических условий эксплуатации изготавливаются и применяются теплоносители на пропиленгликоле в виде водных растворов ( антифризов, хладагентов, незамерзающих жидкостей) с содержанием основного вещества 31%, 37%, 42%, 45%, 50% и 55% и с рабочим диапазоном температур до -15°C, -20°C, -25°C, -30°C, -35°C и -40°C соответственно.
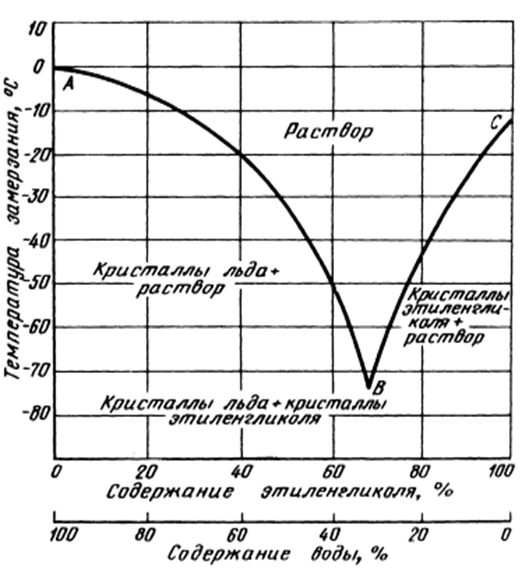
Важнейшим теплофизическим параметром водного раствора пропиленгликоля является зависимость температуры замерзания (кристаллизации) раствора от его концентрации.

пропиленгликоля
Нелинейный характер зависимости температуры кристаллизации водного раствора пропиленгликоля от его концентрации представлены в табл. №1 в виде двух функциональных зависимостей: 1) зависимость температуры кристаллизации водного раствора от его концентрациии и 2) значения величины плотности раствора при температуре 20°C в зависимости от концентрации пропиленгликоля.Табл. №1. Влияние концентрации пропиленгликоля на температуру кристаллизацию водного раствора пропиленгликоля.
| Концентрация пропиленгликоля, % | Температура замерзания, °C | Плотность при 20 °C |
| 31% | -15 °C | 1,023 |
| 36% | -20 °C | 1,028 |
| 42% | -25 °C | 1,032 |
| 45% | -30 °C | 1,035 |
| 50% | -35 °C | 1,038 |
| 55% | -45 °C | 1,040 |
| 60% | -55 °C | 1,042 |
| 65% | -57 °C | 1,043 |
| 70% | -58 °C | 1,044 |
УСЛОВИЯ ХРАНЕНИЯ ПРОПИЛЕНГЛИКОЛЯ
Гарантийный срок хранения пропиленгликоля составляет 5 лет со дня изготовления. Пропиленгликоль при условии соответствия показателей качества норме может быть признан годным к использованию. При транспортировке и для его непродолжительного хранения могут быть использованы емкости из обычной стали, покрытых внутри толстым слоем фенольного лака, однако при длительном хранении необходимо использовать емкости из нержавеющей стали или алюминия.
Концентрированный пропиленгликоль относится к горючим пожаро- и взрывоопасным веществам, при возгорании рекомендуется тушить пенными или порошковыми средствами, а также тонкораспыленной водой. Водные растворы пропиленгликоля – теплоносители ( антифриз, незамерзающая жидкость, хладагент) негорючие вещества.